Axit là gì?
Axit là một hợp chất hóa học có chứa ít nhất một nhóm chức carboxylic (-COOH), tức là chúng có khả năng phản ứng với các chất bazơ để tạo ra muối và nước. Tuy nhiên, có rất nhiều loại axit khác nhau và mỗi loại có tính chất và ứng dụng riêng biệt. Một số ví dụ về các axit phổ biến bao gồm axit sulfuric, axit nitric, axit axetic, axit hydrocloric và axit carbonic.
Phân loại axit
Các axit có thể được phân loại dựa trên nhiều tiêu chí khác nhau, nhưng phân loại phổ biến nhất là dựa trên độ mạnh của axit.
Dựa vào tính chất hóa học của axit
Axit có thể được phân loại dựa trên các tính chất hóa học sau:
Tính chất oxi hóa khử: Axit có thể là chất oxi hóa hoặc chất khử tùy thuộc vào tính chất của nguyên tử liên kết với nhóm axit. Ví dụ, axit sulfuric (H2SO4) là một chất oxi hóa mạnh, trong khi axit clohidric (HCl) không có tính chất oxi hóa khử.
Tính chất điện li: Axit có thể phân chia thành hai nhóm, là axit điện li mạnh và axit điện li yếu. Axit điện li mạnh là axit có khả năng ion hoá cao, giải phóng các ion H+ dễ dàng trong dung dịch. Ví dụ, axit sunfuric và axit nitric (HNO3) là axit điện li mạnh. Trong khi đó, axit axetic (CH3COOH) là một axit điện li yếu, không giải phóng H+ dễ dàng trong dung dịch.
Tính chất axit mạnh hoặc yếu: Axit mạnh là axit có khả năng phân ly hoàn toàn trong dung dịch nước, giải phóng các ion H+ và có tính chất ăn mòn cao. Ví dụ, axit clohidric (HCl) và axit sunfuric (H2SO4) là axit mạnh. Axit yếu là axit chỉ phân ly một phần trong dung dịch nước và có tính chất ăn mòn thấp. Ví dụ, axit axetic (CH3COOH) là một axit yếu.
Tính chất acid-base: Axit có thể phân chia thành axit mạnh và yếu tùy thuộc vào khả năng của chúng để cho các proton lên và tạo thành ion hydroxit. Tính chất acid-base của axit còn được phân loại dựa trên tính chất của cặp axit-bazơ, tức là tính chất của axit khi phản ứng với một bazơ.
Tính chất cấu trúc hóa học: Axit có thể phân chia thành các loại dựa trên cấu trúc hóa học của chúng. Ví dụ, axit cacboxylic (RCOOH) là một loại axit có chứa nhóm cacboxylic, còn axit sulfonic (RSO3H) là một loại axit có chứa nhóm sulfonic.
Dựa vào nguyên tử oxy
Phân loại axit dựa vào nguyên tử oxy được chia thành hai loại chính: axit oxy hóa và axit không oxy hóa.
- Axit oxy hóa: đây là những axit có chứa nguyên tử oxy trong phân tử của chúng. Axit oxy hóa có thể được chia thành hai loại:
- Axit oxo: đây là những axit có chứa nguyên tử oxi và một hoặc nhiều nguyên tử của một nguyên tố khác. Ví dụ: axit sulfuric (H2SO4), axit nitric (HNO3), axit fosforic (H3PO4), axit carbonic (H2CO3).
- Axit oxy-halogen: đây là những axit có chứa nguyên tử oxy, nguyên tố halogen và một hoặc nhiều nguyên tử của một nguyên tố khác. Ví dụ: axit perchloric (HClO4), axit chloric (HClO3), axit hypochlorous (HClO), axit bromic (HBrO3).
- Axit không oxy hóa: đây là những axit không chứa nguyên tử oxy trong phân tử của chúng. Axit không oxy hóa có thể được chia thành hai loại:
- Axit halogen: đây là những axit có chứa nguyên tố halogen trong phân tử của chúng. Ví dụ: axit hydrofluoric (HF), axit hydrobromic (HBr), axit perchlorous (HClO2).
- Axit hidracid: đây là những axit có chứa nguyên tử hydrogen và nguyên tố phi kim trong phân tử của chúng. Ví dụ: axit clohidric (HCl), axit sulfhidric (H2S), axit hydrosulfuric (H2SO3).
Phân loại khác
- Axit mạnh: là axit có khả năng tạo ra nhiều ion hiđro (H+) trong dung dịch nước. Ví dụ: axit sunfuric (H2SO4).
- Axit yếu: là axit có khả năng tạo ra ít ion hiđro (H+) trong dung dịch nước. Ví dụ: axit axetic (CH3COOH).
- Axit béo: là axit có số lượng carbon trong phân tử lớn hơn 10. Ví dụ: axit stearic (CH3(CH2)16COOH).
- Axit hữu cơ: là axit chứa các nguyên tử carbon. Ví dụ: axit axetic (CH3COOH).
- Axit vô cơ: là axit không chứa các nguyên tử carbon. Ví dụ: axit clohidric (HCl).
Cách xác định độ mạnh và yếu của axit
Để xác định độ mạnh và yếu của một axit, chúng ta có thể sử dụng các phương pháp như sau:
- Độ điện li của axit: Độ điện li của axit càng lớn thì nó càng mạnh. Độ điện li của một chất phụ thuộc vào khả năng phân ly thành ion trong dung dịch.
- Độ ion hóa của axit: Độ ion hóa càng cao thì axit càng mạnh. Độ ion hóa là tỷ lệ phần trăm của số phân tử axit phân ly thành ion trong dung dịch.
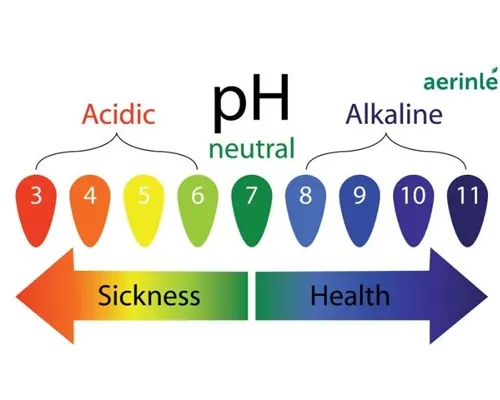
- Độ pH của dung dịch axit: Nếu axit có độ pH thấp hơn thì nó càng mạnh. Độ pH được sử dụng để đánh giá độ axit của dung dịch, với pH càng thấp thì nồng độ ion hydronium càng cao và dung dịch càng axit.
- Độ tan trong nước của axit: Nếu axit tan trong nước tốt hơn thì nó càng mạnh. Độ tan của axit phụ thuộc vào cấu trúc hóa học của nó.
- Tính ổn định của muối của axit: Nếu muối của axit có tính ổn định cao hơn thì axit càng yếu. Tính ổn định của muối của axit phụ thuộc vào khả năng tạo liên kết ion giữa các ion âm và ion âm của muối.
Tuy nhiên, cần lưu ý rằng một axit có thể có độ mạnh khác nhau trong các điều kiện khác nhau, như pH, nhiệt độ, nồng độ,… Do đó, việc xác định độ mạnh và yếu của một axit không phải là một quy trình đơn giản và cần phải xem xét nhiều yếu tố khác nhau.
Axit có những ứng dụng quan trọng gì?
Axit là một loại hợp chất hữu cơ hoặc vô cơ chứa ít nhất một nhóm -COOH. Các axit có rất nhiều ứng dụng trong đời sống và công nghiệp, bao gồm:
- Sản xuất phân bón: Axit sunfuric và acid phosphoric được sử dụng để sản xuất phân bón.
- Tẩy rửa và làm sạch: Axit sulfuric và hydrocloric được sử dụng để tẩy rửa và làm sạch.
- Chế biến thực phẩm: Các axit như citric acid, acetic acid và lactic acid được sử dụng để tăng độ chua, làm chua và bảo quản thực phẩm.
- Sản xuất thuốc: Các axit như benzoic acid và salicylic acid được sử dụng để sản xuất các loại thuốc khác nhau.
- Sản xuất nhựa và sơn: Axit acrylic và methacrylic được sử dụng để sản xuất các loại nhựa và sơn.
- Xử lý nước: Axit sulfuric và hydrocloric được sử dụng để điều chỉnh pH trong quá trình xử lý nước.
- Sản xuất pin: Axit sulfuric được sử dụng để sản xuất pin.
- Chế tạo kim loại: Axit nitric và hydrocloric được sử dụng để tẩy rửa và xử lý bề mặt kim loại.
Trên đây chỉ là một vài ví dụ về ứng dụng của axit. Tùy thuộc vào loại axit và tính chất của chúng, các ứng dụng của axit có thể khác nhau.
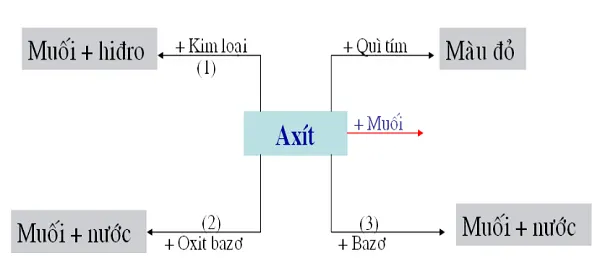
Tính chất hóa học của axit
Axit làm đổi màu chất chỉ thị màu
Axit có thể làm thay đổi màu của một số chất chỉ thị màu, đặc biệt là chất chỉ thị pH. Cụ thể, khi axit được thêm vào dung dịch chứa chất chỉ thị pH, nó sẽ tạo ra môi trường có độ axit cao hơn, gây ra sự thay đổi màu của chất chỉ thị.
Ví dụ, phenolphthalein là một chất chỉ thị phổ biến trong phép đo pH, nó sẽ chuyển từ màu hồng sang màu trắng trong môi trường axit. Nếu axit được thêm vào dung dịch chứa phenolphthalein, màu của dung dịch sẽ thay đổi từ màu hồng sang màu không màu hoặc màu trắng.
Tuy nhiên, không phải tất cả các chất chỉ thị đều bị ảnh hưởng bởi axit. Ví dụ, chất chỉ thị metyl da cam sẽ không bị ảnh hưởng bởi axit và vẫn giữ nguyên màu sắc của nó khi axit được thêm vào.
Axit tác dụng với kim loại
Axít có thể tác dụng với các kim loại để tạo ra muối và khí hydro. Quá trình này được gọi là phản ứng axit-bazo.
Trong phản ứng axit-bazo, axit thường tạo ra ion hiđro (H+) trong dung dịch, còn kim loại thường tạo ra ion dương (M+). Khi axit và kim loại tương tác với nhau, ion hiđro sẽ kết hợp với ion dương để tạo ra muối, còn khí hydro sẽ được giải phóng.
Ví dụ, khi axit clohidric (HCl) tác dụng với kim loại natri (Na), ta có phản ứng sau:
2HCl + 2Na → 2NaCl + H2
Trong đó, axit clohidric (HCl) tạo ra ion hiđro (H+) trong dung dịch, còn kim loại natri (Na) tạo ra ion dương Na+. Ion hiđro kết hợp với ion dương Na+ để tạo ra muối NaCl, còn khí hydro được giải phóng.
Axit tác dụng với bazơ tạo thành muối và nước
Axit có tính chất hoá học là chất có khả năng nhường điện tử cho các chất khác. Trong khi đó, bazơ là chất có khả năng nhận electron từ các chất khác. Khi axit tác dụng với bazơ, các phân tử axit sẽ nhường điện tử cho các phân tử bazơ, tạo thành liên kết ion trong đó các ion dương của bazơ liên kết với các ion âm của axit.
Quá trình này gọi là phản ứng trung hòa axit-bazơ và kết quả của nó là tạo thành muối và nước. Ví dụ, khi axit clohidric (HCl) tác dụng với bazơ natri hidroxit (NaOH), phản ứng trung hòa sẽ tạo ra muối natri cloua (NaCl) và nước (H2O) theo phương trình hóa học sau:
HCl + NaOH → NaCl + H2O
Trong phản ứng trên, HCl là axit, NaOH là bazơ, NaCl là muối và H2O là nước.
Axit tác dụng với oxit bazơ tạo thành muối và nước
Axit có tính chất là chất có khả năng tạo ra ion H+ (hay còn gọi là proton) trong dung dịch, trong khi đó oxit bazơ có tính chất là chất có khả năng tạo ra ion OH- trong dung dịch.
Khi axit tác dụng với oxit bazơ, các ion H+ của axit sẽ tương tác với các ion OH- của oxit bazơ để tạo thành nước (H2O), trong khi đó các ion của axit và oxit bazơ còn lại sẽ kết hợp với nhau để tạo thành một muối. Quá trình này được gọi là phản ứng trung hòa axit-bazơ và được biểu diễn bằng công thức sau:
Axit + Oxit Bazơ → Muối + Nước
Ví dụ: phản ứng giữa axit clohidric (HCl) và oxit bazơ kali (KOH) sẽ tạo ra muối cloua kali (KCl) và nước (H2O):
HCl + KOH → KCl + H2O
Axit tác dụng với muối
Axit có thể tác dụng với muối để tạo ra các phản ứng khác nhau. Dưới đây là một số ví dụ:
- Axit có thể tác dụng với muối để tạo ra axit muối. Ví dụ, khi axit sulfuric (H2SO4) tác dụng với muối natri clorua (NaCl), axit muối sulfuric-natri (NaHSO4) được tạo ra theo phản ứng sau:
H2SO4 + NaCl → NaHSO4 + HCl
- Axit cũng có thể tác dụng với muối để tạo ra muối khác. Ví dụ, khi axit clohidric (HCl) tác dụng với muối natri hidroxit (NaOH), muối natri clođua (NaCl) và nước (H2O) được tạo ra theo phản ứng sau:
HCl + NaOH → NaCl + H2O
- Trong một số trường hợp, axit có thể tạo ra phản ứng phân hủy muối. Ví dụ, khi axit nitric (HNO3) tác dụng với muối natri nitrát (NaNO3), oxit nitơ (NO2) và nước (H2O) được tạo ra theo phản ứng sau:
2HNO3 + NaNO3 → 2NO2 + Na2O + 2H2O
Tuy nhiên, không phải tất cả các axit đều có thể tác dụng với tất cả các muối để tạo ra các phản ứng như vậy. Một số axit có tính chất hóa học đặc biệt và chỉ tác dụng được với một số loại muối cụ thể.
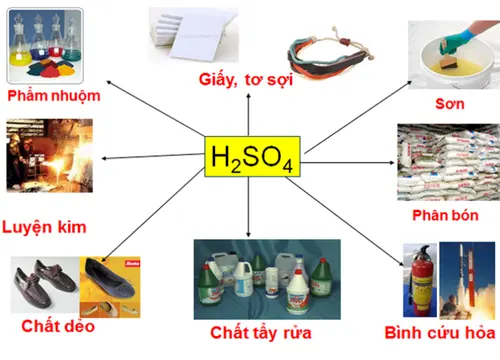
Một số ứng dụng quan trọng của axit trong cuộc sống
Axit là một hợp chất hóa học quan trọng được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau của cuộc sống. Sau đây là một số ứng dụng quan trọng của axit trong cuộc sống:
- Axit được sử dụng trong sản xuất thuốc: Nhiều loại thuốc được sản xuất từ axit và các dẫn xuất của nó. Ví dụ, aspirin, một loại thuốc đau nhẹ rất phổ biến, được sản xuất từ axit salicylic.
- Axit được sử dụng trong sản xuất thực phẩm: Axit axetic, một loại axit hữu cơ, được sử dụng rộng rãi trong sản xuất thực phẩm như gia vị, dấm và các loại nước chấm. Axit citric cũng được sử dụng rộng rãi trong ngành công nghiệp thực phẩm, đặc biệt là trong sản xuất nước giải khát.
- Axit được sử dụng trong sản xuất phân bón: Axit sunfuric, một loại axit khoáng, được sử dụng trong sản xuất phân bón và các chất hoá học khác trong ngành nông nghiệp.
- Axit được sử dụng trong sản xuất điện thoại di động: Axit nitric được sử dụng trong sản xuất điện thoại di động và các thiết bị điện tử khác.
- Axit được sử dụng trong sản xuất xăng: Axit sunfuric được sử dụng trong quá trình sản xuất xăng.
- Axit được sử dụng trong quá trình sản xuất và chế biến kim loại: Axit hydrochloric được sử dụng trong sản xuất và chế biến kim loại như sắt và đồng.
- Axit được sử dụng trong quá trình xử lý nước: Axit sunfuric và axit hydrochloric được sử dụng trong quá trình xử lý nước, đặc biệt là để điều chỉnh độ pH.
Tóm lại, axit là một thành phần quan trọng của nhiều sản phẩm và quy trình trong cuộc sống hàng ngày của chúng ta. Tuy nhiên mọi người nên biết sử dụng axit đúng cách, đúng liều lượng nhằm đảm bảo an toàn cho sức khỏe và môi trường sống xung quanh.
Ngày cập nhật: 15:14 - 03/04/2023